做过染一抗➕用染料探针染细胞器组合的免疫荧光,也做过染不同抗体的免疫荧光,不过个人最多只做过3个抗体,以两个抗体来举例吧~[黄金薯R]
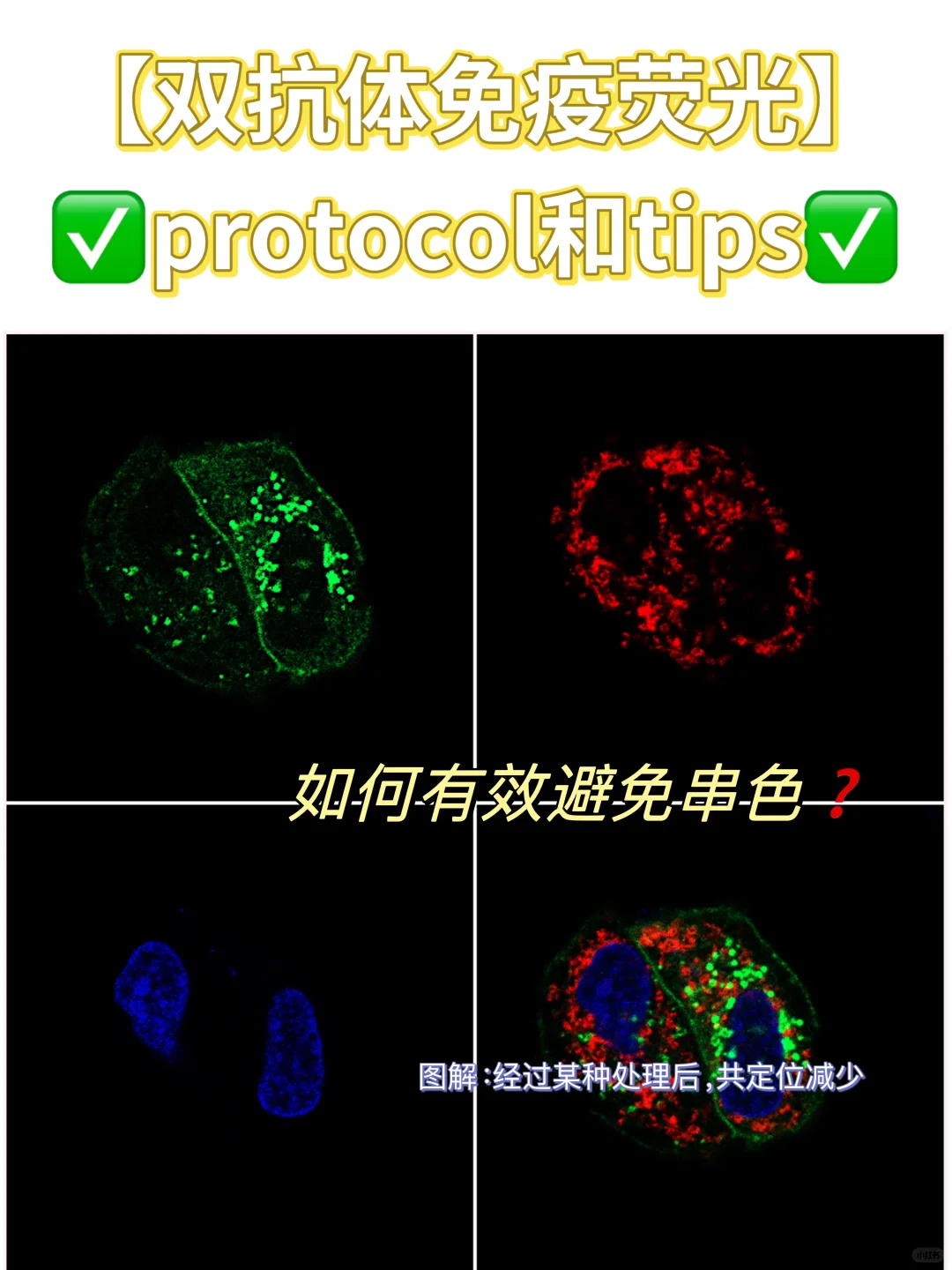
[蹲后续H]分享一下关于IF的protocol,以及双抗体免疫荧光的tips,如何有效避免串色❓
✅protocol在图2文字部分,大家自行拿图;
✅如何有效避免串色❓
🌟1、铺细胞别太密,且尽可能用大体积细胞
➡️太密就导致一抗结合蛋白增多,更容易出现非特异性染色,且细胞太密拍摄效果很一般,一般6孔板满孔的细胞我会取1/8的量铺到带有爬片的12孔板里,大概12小时后,细胞密度就刚刚好。
➡️用大体积细胞(例如HeLa),拍摄效果好,HEK细胞相对来说效果欠佳,若用非工具细胞,就无需考虑这个问题。
🌟2、核放在最后染
双抗体染色时可不用活细胞染核液(Hoechst),也就是不要最开始染核,放到最后封片时,用DAPI染,DAPI浓度不要过高,核很容易被染色,低浓度染色即可。
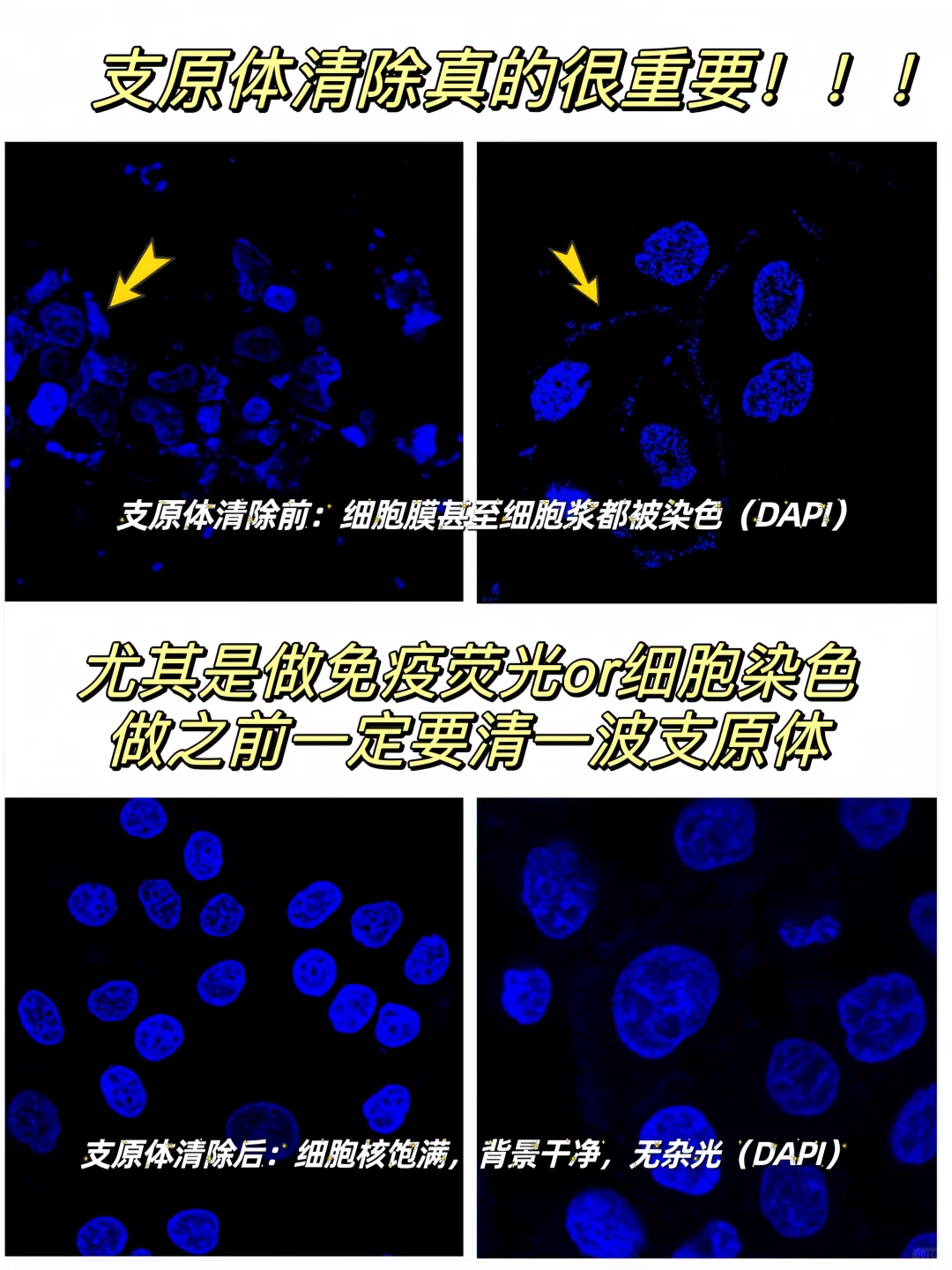
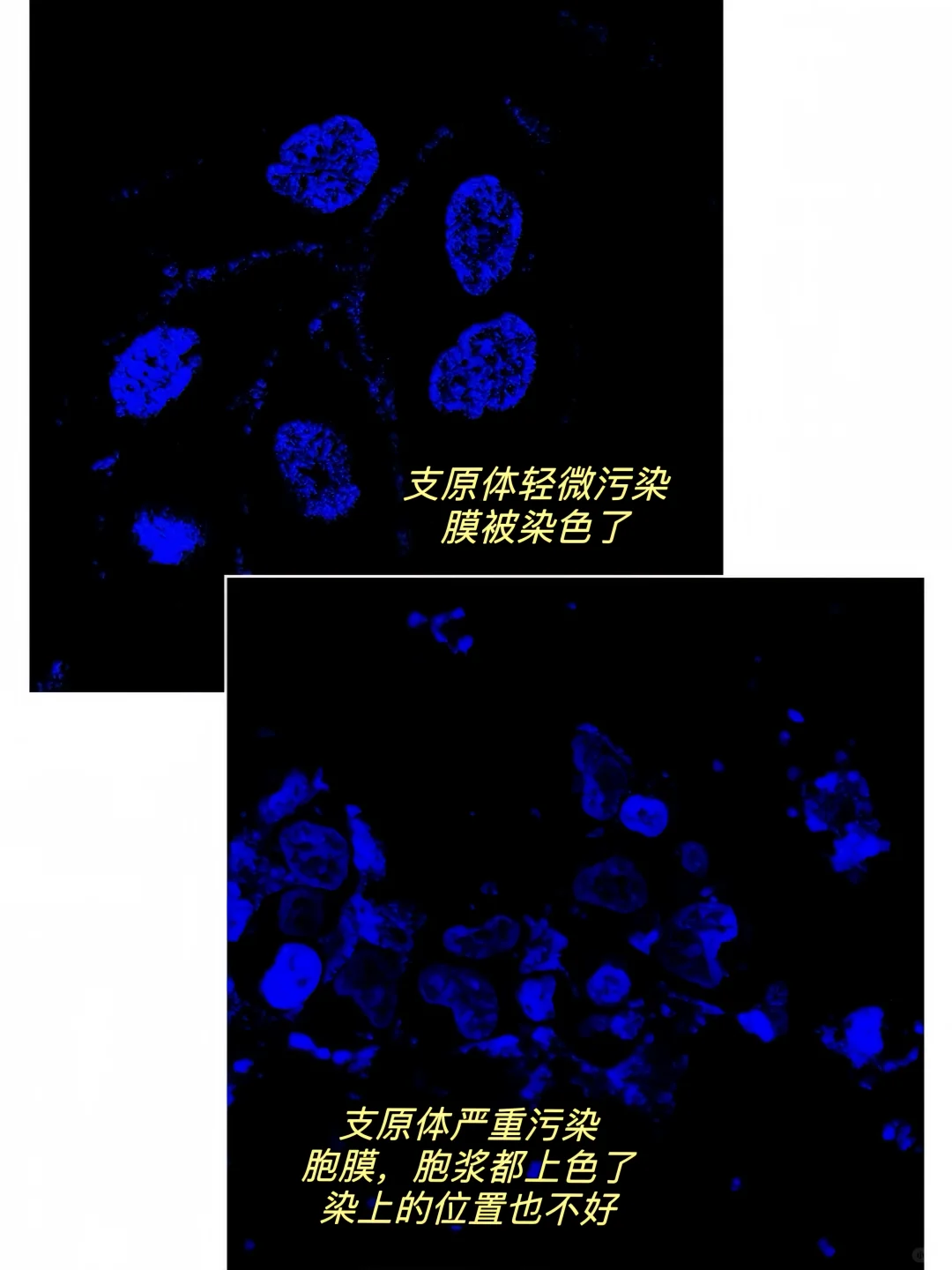
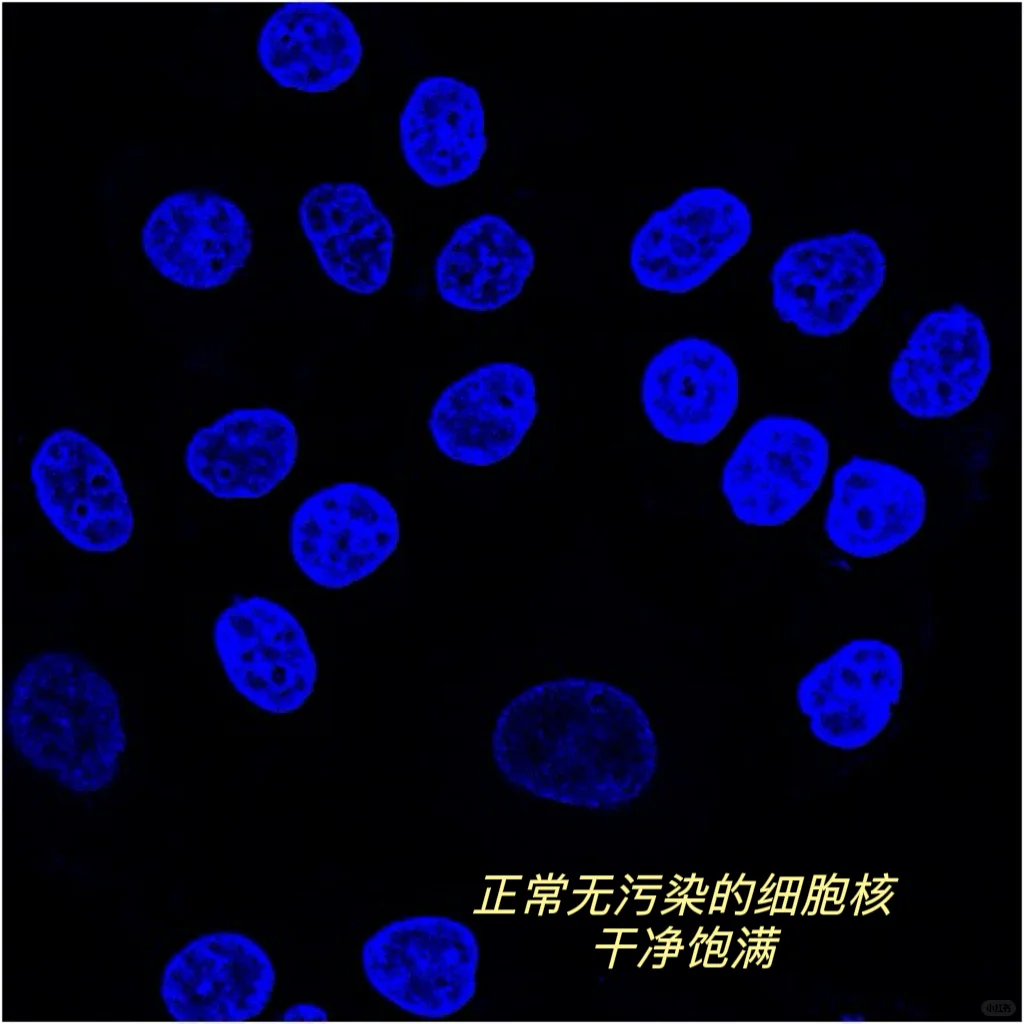
🌟3、支原体清除后再做IF(图4)
用状态好,未被污染的细胞去做IF,状态好的细胞伸展很开,染色效果也更好,若细胞支原体污染,可能会产生图4图5的现象,非特异性染色严重且去不掉,染核染抗体都会被染上乱七八糟的东西。
🌟4、一抗浓度的问题
➡️双抗体染色若外转质粒,可染标签抗体,标签抗体更特异且使用浓度低,一般都在1:500左右;
➡️若染内源性蛋白,浓度可1:200,做之前记得看下抗体说明书该抗体是否可以做IF;
➡️4度过夜染效果更好,一抗可回收,负20保存,大概可用3次,根据抗体灵敏度决定使用次数;
➡️双抗体IF,一定要用不同抗性的,一个用鼠,一个用兔,最好不要双鼠or双兔。
🌟5、二抗
常温孵育1~2h,避光,避开同属性的二抗,洗一抗可用pbs,二抗可以用tbst,多加一些吐温。
🌟6、拍摄
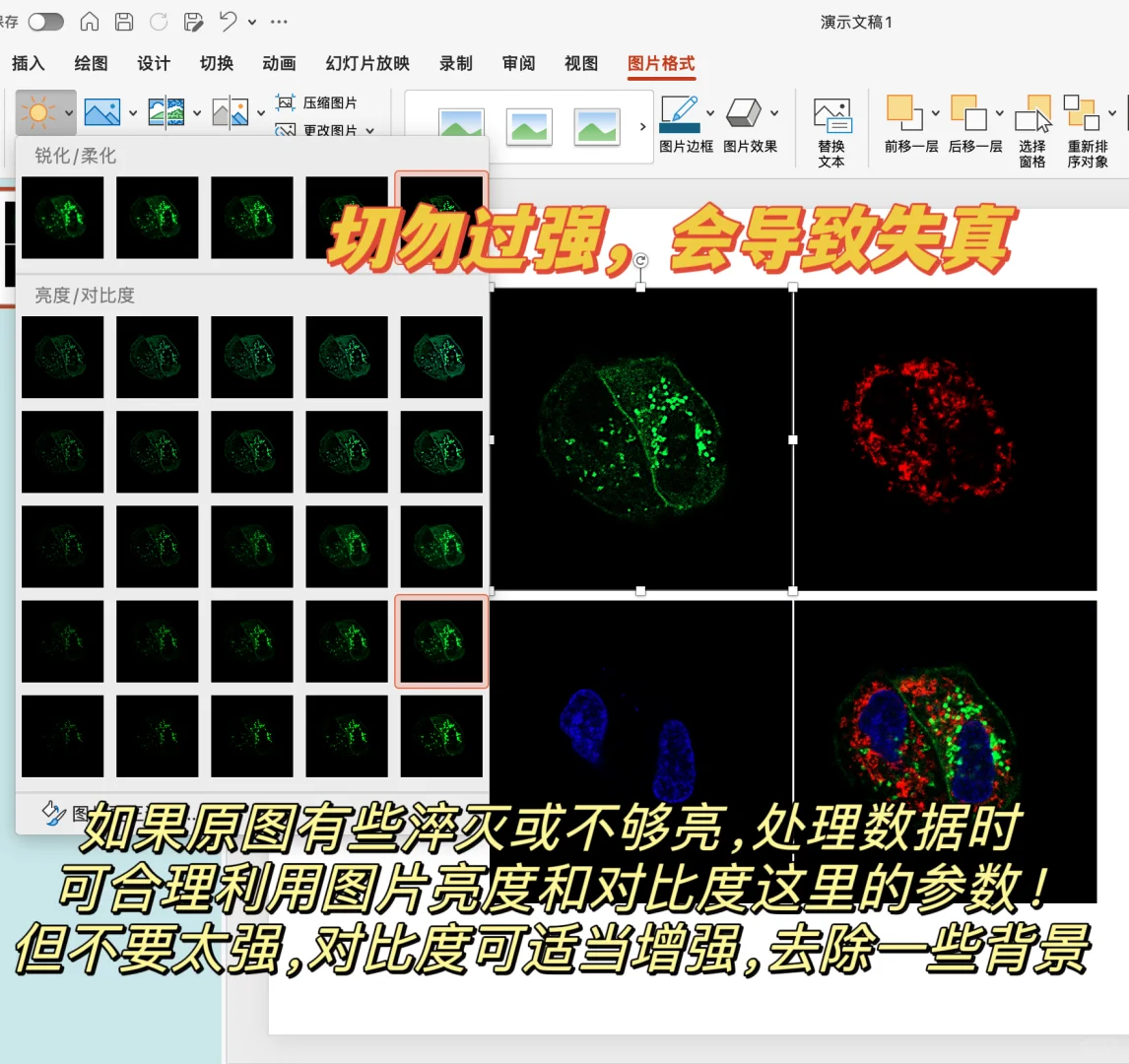
封片后拍摄时,可以适当缩短激发光波长,使其没有交叉波长。
比较好的选择:绿光488,红光555。













行只
码了请问师姐 支原体清除剂可以用吗?在哪一步加比较好呀
香菜丸子
真的很详细,太用心
李兴光
学费了